【人気ダウンロード!】 化学反応式 係数 301761-化学反応式 係数 中学
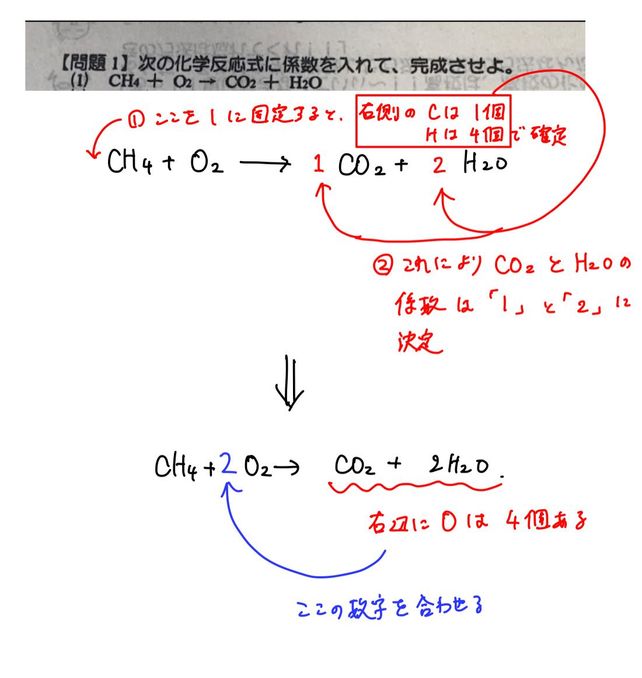
/06/18 · 一般的に、化学反応式の係数を求める方法としてはじめに習う方法は目算法(他にも呼び方は有ります。 )です。 これは、反応式の左右の分子の係数を過不足ないように"手動"で調整するもの係数を合わせる 原子の記号の前につく数字のことを 係数 と言います。 化学反応式では、 左側の原子の数と右側の原子の数を合わせなければならず 、この係数を使って調整します。 まずは係数がなにもついていない状態の化学反応式です。 左側の原子しかし、化学反応式の係数「1」は書かないという約束があるので、係数1は外します。 こうして、 CH 4 + 2O 2 → CO 2 + 2H 2 O

化学反応式の係数の求め方 教えて下さい 中2です 画像悪くてすみません Clear
化学反応式 係数 中学
化学反応式 係数 中学-係数が簡単に決められない化学反応式があります。 そのようなときには,係数を未知数とし,両辺の各原子数に関する連立方程式をつくり,その値を求める未定係数法という方法を使います。 例えば,アセチレンC 2 H 2 を完全に燃やすと,二酸化炭素CO 2Ca(OH) 2 H 3 PO 4;



化学反応式 係数 作り方 書き方 計算問題の解き方など 化学のグルメ
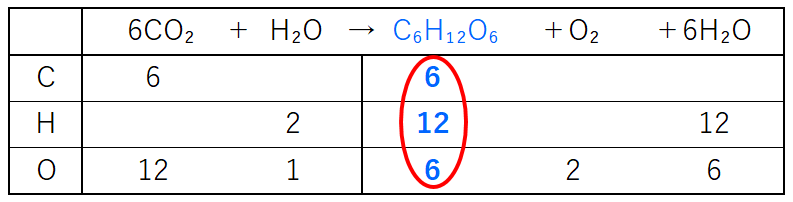
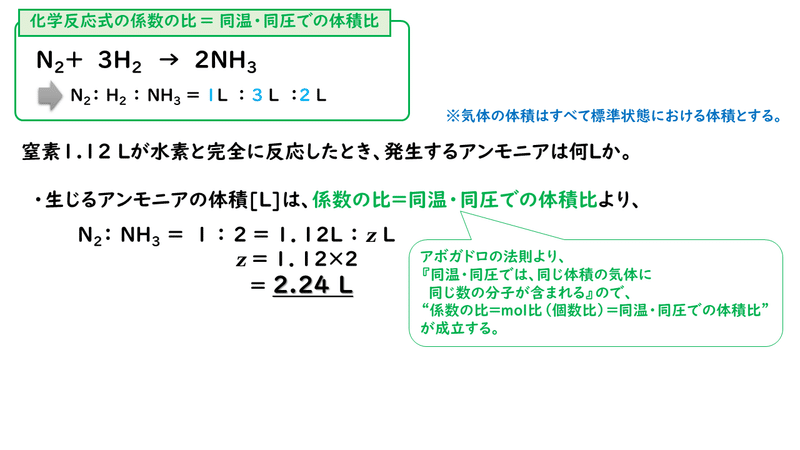
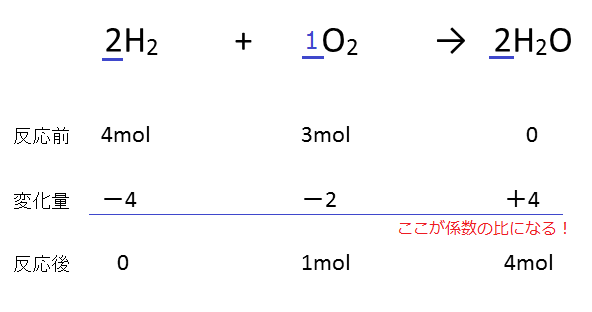
多くの反応において、反応次数は化学反応式の係数とは一致しない。 例として、塩化水銀(II)とシュウ酸 イオンの反応を挙げる。この反応の反応式は以下の通り。 2 HgCl 2 C 2 O 4 2− (aq) → 2 Cl − (aq) 2 CO 2 Hg 2 Cl 2 この反応の反応速度は以下のように表されるC 8 H 18 O 2;この反応式の意味は、 水素分子2molと酸素分子1molが反応して、水分子2molが出来る という意味でした。 大切なのは、この 係数の比は変化量についてのみ成立 しているということです。 計算が出来ていない人の多くに共通するのが、以下のことを意識できていないことです。
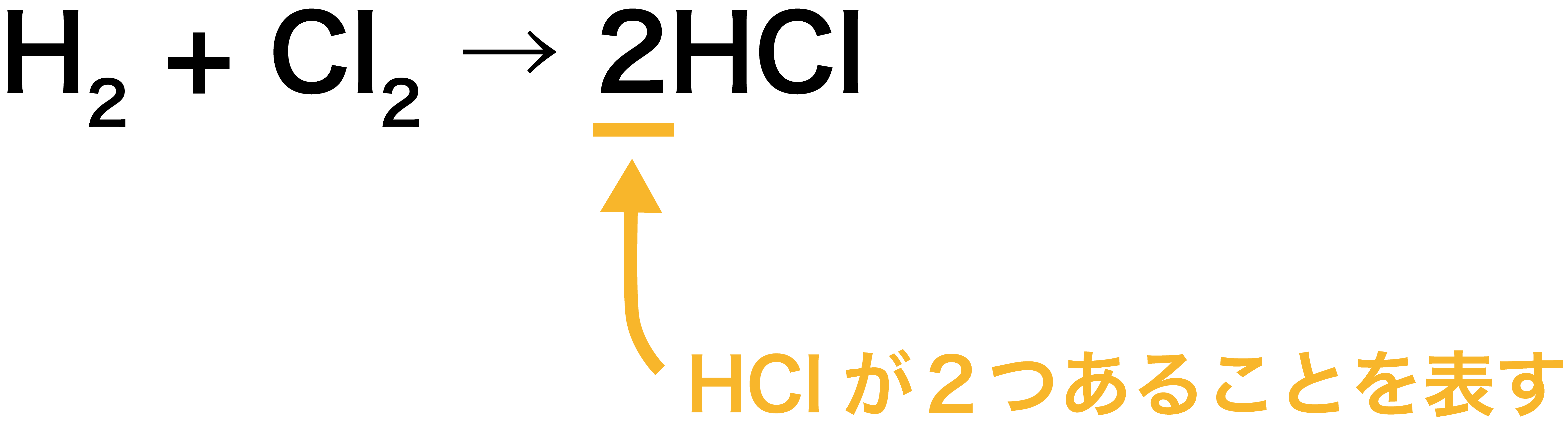
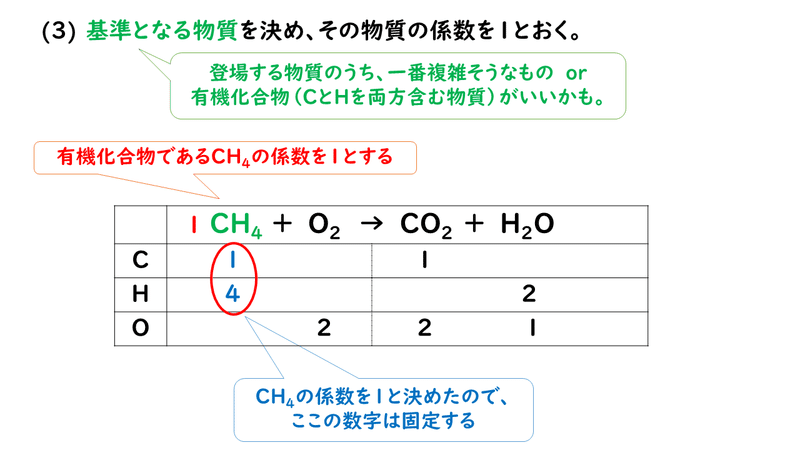
· モル比は、中量の比であるモル任意の二つの化合物に関与する化学反応。 モル比が使用されている換算係数として製品との間に多くの化学の問題での反応物。 モル比は、平衡化学式で式の前に係数を調べることによって決定することができます。画像の反応式を書きます ここで係数決めの大事なルールをいいます 係数決めには、目算法と未定係数法があります。今回は目算法です。普段やっている方法です ①左辺右辺を見て、一番難しい化学式の係数をまず1としてみる · さて、 係数とは何のこと かというと、 2H 2 + O 2 → 2H 2 O などの化学反応式の の でかこった「2」の部分 (大きい数字)のことだよ。 この化学反応式では、「H 2 」の前と、「H 2 O」の前にそれぞれあるね。 ふーん。 化学式の前につく、 大きい数字のことを「係数」 という んだね
イントロ「化学反応式が表すもの」(2分4秒) vtr「一酸化炭素と酸素で二酸化炭素ができる実験」(2分30秒) 化学反応式の係数が示すものは?(2分23秒) vtr「係数と物質量」(2分47秒) 化学反応式の量的関係(4分38秒) 塩素酸カリウムは何グラム必要?Na 2 S 2 O 3 I 2; · 化学反応式のつくり方(係数の合わせ方) 中学2年 Tweet 目算法による化学反応式のつくり方 中学理科応援「一緒に学ぼう」ゴッチャンねる 642 subscribers Subscribe 5分10秒でわかる 目算法 による 化学反応式の作り方 初歩編




理科 中2 7 化学反応式の作り方 Youtube




未定係数法をなるべく使わない 化学がちょっとだけ好きな社労士
化学反応式の係数より Mg :O 2 = 2:1 の関係なので,Mg 030 mol0 のとき,反応 に必要なO 2= 0150 mol となる。よって,反応せずに残る物資は酸素(O 2)である。 反応せずに残る O 2 の物質量は,0250 mol − 0150 mol = 0100 mol となる。 反応せずに残る O 2実際に例題を解いてみましょう。 例題(1) ある金属Mの酸化物M 2 O 3 85gをコークスで還元したところ、45gの金属Mが得られた。この金属の原子量を求めなさい。 (解説・解答) まずは、化学反応式を作りましょう。 · 係数をどのように調整するかは、水素分子(H2)と酸素分子(O2)が結合して水(H2O)になる場合の化学反応式を例に見てみましょう。 この場合、Hの前に入っている係数2を以下のように調整します。 2H2+O2→2H2O




Ch4 O2 4 Co2 H2c Descubre Como Resolverlo En Qanda




化合と化学反応式 無料で使える中学学習プリント
· 化学反応式において、分数を係数として使うことはできません。 化学反応では、一つの分子または原子はそれ以上細かく分割できないからです。 係数を合わせる計算過程で分数を使う場合化学反応式の係数を決める 反応式の係数を求める時のポイントです。 高校化学ヘルパー(教科書の行間に隠れたヒケツ)koukoukagakuorgも係数は整数だから,全体を2倍すると,次の化学反応式が得られる。 2C 2 H 2 +5O 2 →4CO 2 +2H 2 O 次はイオン反応式です。




化合と化学反応式 無料で使える中学学習プリント




Descubre Como Resolverlo En Qanda
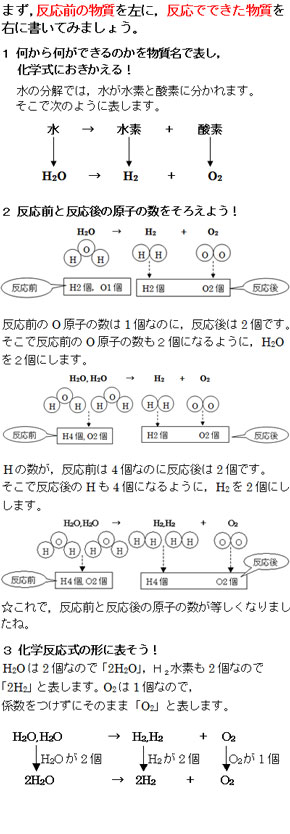
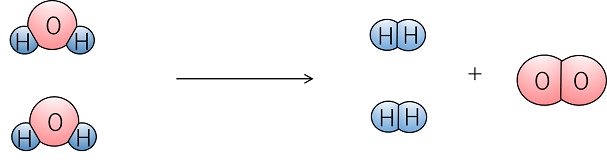
化学反応式の書き方 例1 水素の燃焼・・・水素+酸素→水 化学式・・・水素 (H2),酸素 (O2),水 (H2O) まず、水素+酸素→水をモデルと化学式で表す 両辺原子の数を数える 左辺のOが2個、右辺が1個なので右辺の水分子を増やす 右辺の物質は水なので、酸素これを化学式で表してみよう。 例)水 h 2 o を電気分解すると酸素 o 2 と水素 h 2 になる。 (→の左側と右側で原子の数が同じでなければならない。この場合, h 2 o を 2 つにするとうまくいった。) このように,化学反応を化学式と係数で表した式を〔 化学係数のつけ方 化学反応式は→の左右で原子の数を合わせることが大事ですが、原子の数が多くなるとモデルではかえって考えにくくなります。 そんなときは数学の連立方程式を使って係数を求めることができます。 例題の手順の③からが今回の




化学反応式の係数のつけ方が読むだけでわかる




ほとんどのダウンロード 未定係数法 やり方 人気の画像をダウンロードする
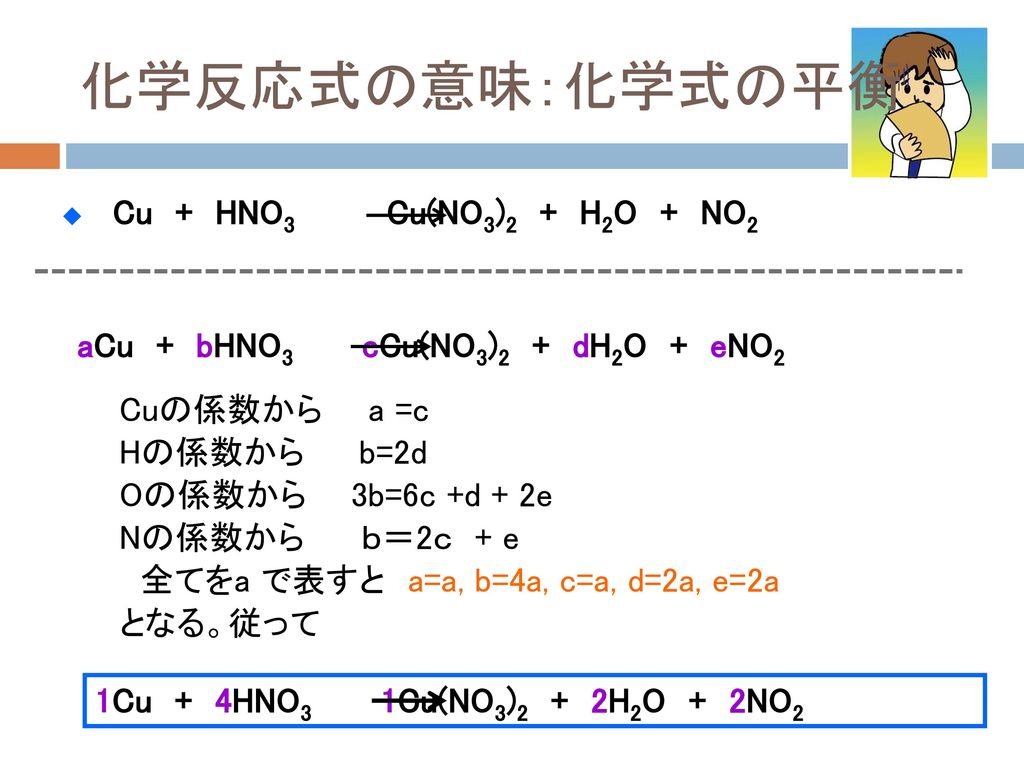
O=C=O O=C=O O=C=O したがって C原子が3個とO原子が6個あることを意味しています。 つまり それぞれの原子の数=係数×それぞれの元素記号の右下の数 (原子数) 5-2-3 化学反応式の係数の求め方 (暗算法) 少し余談ですが、単体で、気体の物質は普通2原子で1つの分子を構成しています。 H 2 , O 2 , N 2 , F 2 , Cl 2, 水素と酸素が反応して、水が生成するときの化学反応式を考え · 今イオンの係数がcuが2+ Alが3+となっていますよね? 反応式は右辺と左辺の電子の量や原子の数が一致していないといけないので、今の場合は2Al+3cu2+→2Al3+ +3cuとなります。 こうすると電子の数は6個でつり合いますし、原子の数もつりあいます! · 化学反応式の基本ルール である 「反応の前後で、原子の数は変わらない」 を使って、係数がアルファベットのまま各原子の数を比べると、方程式ができる。 まず炭素について。 炭素原子は左側にa×6コ、右側にc×1コある。 反応の前後で原子の数は変わらないため、 ・・・① 6 a = c ・ ・ ・ ① 同様に、酸素について、 ・・・② 6 a 2 b = 2 c d ・ ・ ・ ② 水素に




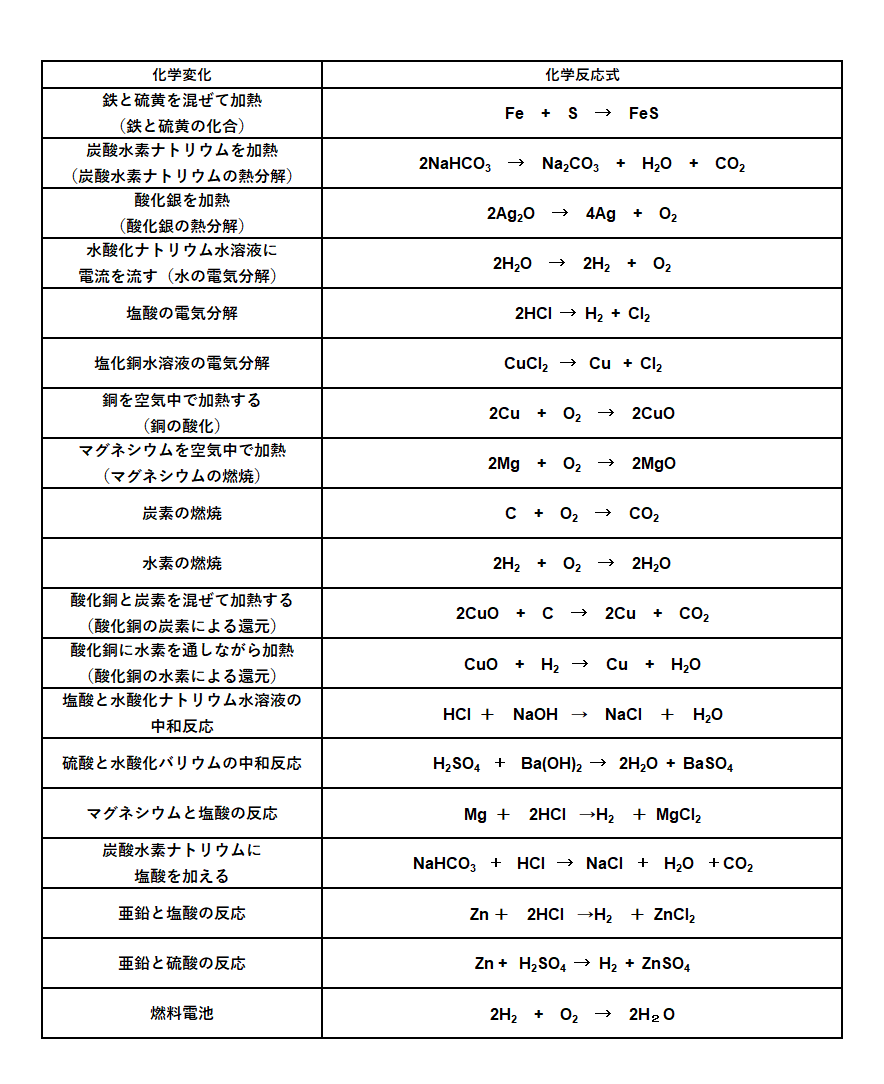
中学生の未来のトビラ V Twitter 中学で習う化学反応式は ものすごく少ないので がんばって覚えてください 物質名 化学式 変化 できたら 化学反応式の係数の作り方も覚えておくと化学反応が無限に広がる高校で役に立つと思います 無理だったら高校入試に向けて




モノマナビ研究所
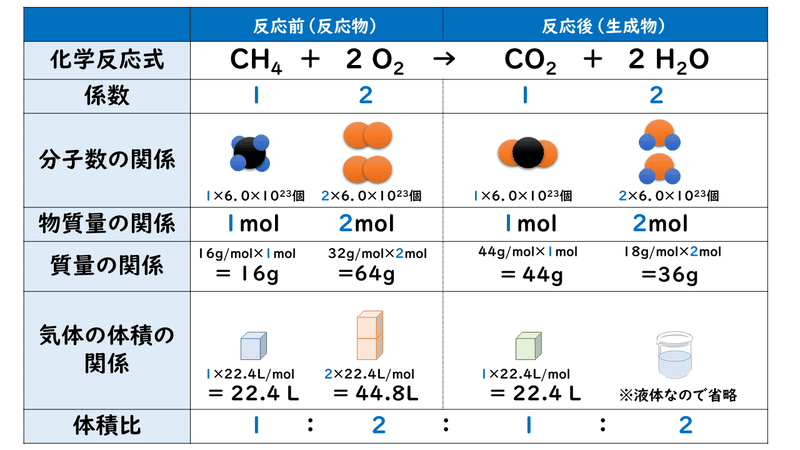
ローザが化学反応式の美しさに見入っています。 メタンと酸素で二酸化炭素と水ができる反応では、 CH 4 + 2O 2 → CO 2 + 2H 2 O と、左辺と右辺で、原子の種類も数もまったく同じになっており、それぞれの物質につけた係数によって調節されています。化学反応式 チェックテスト カッコに数字を入れて化学反応式を完成させよ。 ただし数字を入れる必要のないところは空らんにせよ。 水の電気分解 水→水素酸素 2 H2 O → 2 H2 O2 マグネシウムの酸化 マグネシウム酸素→酸化マグネシウム 2 · 目次 1 未定係数法で化学反応式を作るための手順 11 1化学反応に登場する物質の係数を文字式で置く 12 2左辺と右辺で元素ごとに関係式を作る 121 Oに着目 13 31つの文字を1とする(登場回数が多いもの) 14 4文字の答えを元の式に代入し分数を排除



イオン反応式 Japaneseclass Jp




宇宙一覚えやすい 化学反応式ハンドブック 惟希 船登 本 通販 Amazon
はじめに ここでは化学反応式について勉強をしていきましょう。 化学反応とは 水を冷凍庫にいれておくと氷に変化します。また、水を沸騰させると水蒸気に変化します。このように物質は同じでも状態が変わる変化のことを物理変化と言います。一方で、あらかじめあ11年度「化学」(担当:野島 高彦) モルと化学反応式 0 なぜモルについて理解しなければならないのか なぜモルなどという考え方を理解しなければならないのだろうか?化学反応式の計算機 ― オンライン 化学反応式の係数を計算します。反応前の物質の分子式と、反応後の物質の分子式を入力してください。 大文字、小文字を厳密に入力してください。分子式と分子式の間はスペースを入れてください。 分子式に係数は付けないでください。誤:2h2o 正:h2o



中2の理科化学反応式なんですが 係数2がつく理由がわかりません Yahoo 知恵袋




楽天kobo電子書籍ストア 化学反応式における量的な関係 係数に見るミクロとマクロの話 原 智康
という化学反応式を例に挙げます。 化学反応式では、 「係数のつけ方」 が特に大事なので 注目してくださいね! (1)まずは、「物質名」と「→」で表す。 水素 + 酸素 → 水 (2)これを、化学式で置き換える。 H₂ + O₂ → H₂Oそれは、 化学反応式を立てる ことです。 化学反応式ができれば、各物質の 係数 の比がわかります。 それがわかれば、 物質量 の比や 体積 の比、 質量 の比などがわかるようになるのです。化学反応式試薬の例(完全な方程式が提案されます): H 2 SO 4 K 4 Fe(CN) 6 KMnO 4;



代謝 化学反応式



イオン反応式の係数の求め方がよくわかりません やり方を Yahoo 知恵袋




化学反応 とは何か 反応式が書けるように元研究員が解説 ページ 2 2 Study Z ドラゴン桜と学ぶwebマガジン




化学反応式と量的関係 化学反応式の書き方について 化学基礎 定期テスト対策サイト




化学反応式の作り方 係数を100 正確に付ける未定係数法を徹底解説




中学理科 化学反応式の作り方 問題の解き方がわかる3ステップ Qikeru 学びを楽しくわかりやすく



1 Ch4o2 11 00 Descubre Como Resolverlo En Qanda




化学反応式の係数を決める Youtube



2 o 問1 次の各化学反応式に係数を入れよ




高校化学基礎 化学反応式と係数 映像授業のtry It トライイット




化学反応式の係数のつけ方が読むだけでわかる




高校化学基礎 化学反応式 練習編 映像授業のtry It トライイット




高校化学基礎 化学反応式と係数 映像授業のtry It トライイット



中2化学 化学反応式 中学理科 ポイントまとめと整理




化学反応式に係数をつける方法 10 ステップ 画像あり Wikihow




化学反応式の係数を合わせる という問題なのですが Clear




イオン反応式の物質についている係数は酸化数に関係あるんですか Clear




化学反応式の係数 化学がちょっとだけ好きな社労士



画像 中2 理科 化学反応式 問題 ポケモン サンムーン 中古



5 1 化学反応式 おのれー Note




夕凪亭別館 写真館 10 化学反応式




熱化学方程式の解き方 基本からわかりやすく解説 高校生向け受験応援メディア 受験のミカタ



教養の化学 第14週 14年1月日 担当 杉本昭子 Ppt Download




化学の化学反応式について この問題の一番最後のo2がなぜ3になるのかわか Okwave




化学反応式の係数を簡単に出す方法 おときち副塾長 電脳空間学習塾かもん Youtube
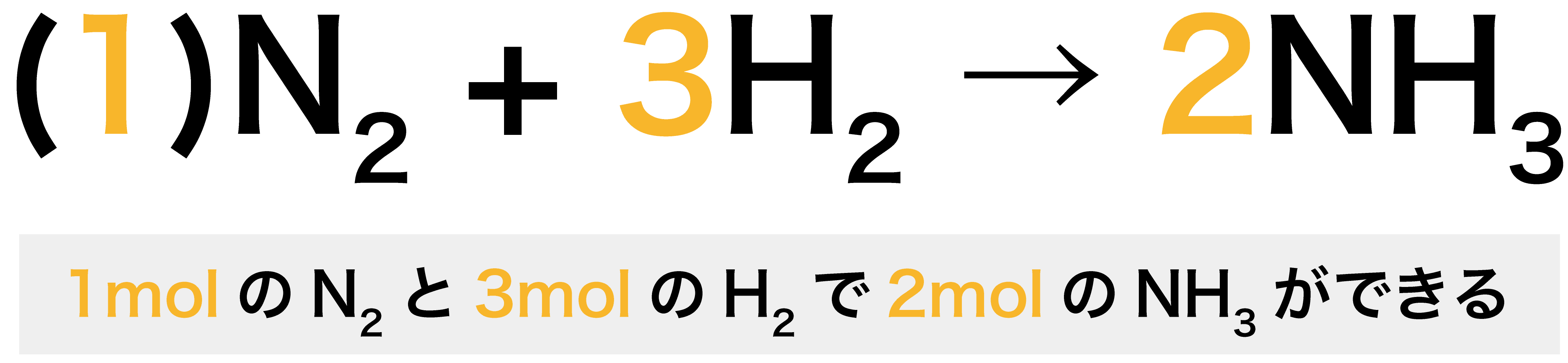



化学反応式 係数 作り方 書き方 計算問題の解き方など 化学のグルメ




アルミニウム Al やマグネシウム Mg の完全燃焼の化学反応式 酸化アルミニウム 酸化マグネシウム




宇宙一覚えやすい 化学反応式ハンドブック 惟希 船登 本 通販 Amazon




化学反応式 係数 作り方 書き方 計算問題の解き方など 化学のグルメ



Search Q E5 8c 96 E5 Ad A6 E5 8f 8d E5 Bf 9c E5 8f E8 A6 9a 81 E6 96 B9 Tbm Isch



5 2 化学反応の量的関係 1 おのれー Note




この化学反応式を自分で書いて呼吸商を求めなければいけないのですが 係数のつけ方がしっ Clear




半反応式か化学反応式か 鉛蓄電池の典型問題 化学がちょっとだけ好きな社労士



受験基礎化学 19 化学反応式と物質量 みかみの参考書ブログ




未定係数法は化学反応式の係数が絶対にわかる裏技だ 三重の個人契約家庭教師




化学式に分数がある場合 化学がちょっとだけ好きな社労士



化学反応式の正しい計算



化学反応式の係数 Youtube



化学基礎の化学反応式の係数の付け方を教えて下さい 写真の化学 Yahoo 知恵袋




化学反応式 Chemihack おうちで学べる化学




高校理論化学 化学反応式と化学反応の量的関係 過不足のある反応 混合気体の燃焼 混合物の純度 受験の月




化学反応式の係数の求め方 教えて下さい 中2です 画像悪くてすみません Clear




5 2 化学反応の量的関係 1 おのれー Note




1 Descubre Como Resolverlo En Qanda




62 1 10 11 O2 Mgo71c Descubre Como Resolverlo En Qanda




110 3 4 の解くコツってありますか Clear



化学反応と熱 乙4特訓




高校化学基礎 化学反応式の書き方 映像授業のtry It トライイット




110 3 4 の解くコツってありますか Clear



1



化学反応式の係数を答える問題なのですが 6 教えてください Yahoo 知恵袋




化学基礎 化学反応式のつくり方 未定係数法 Tekibo



育志館講師ブログ




Ppt 化学反応式 化学式を用いて化学変化を書いた式 や で反応系と生成系を結ぶ イオン反応式 水溶液での反応で 関与する分子 イオンのみを含む で結ぶ Powerpoint Presentation Id




化学反応式と量的関係 過不足が発生するときの反応後の量を求める過程がわかりません 化学基礎 定期テスト対策サイト




モノマナビ研究所




化学基礎 化学反応式 その2 作り方 Youtube




K6j4ge O0vem




イオン反応式の係数の求め方がわかりません お願いします Clear



5 2 化学反応の量的関係 1 おのれー Note




イオン反応式の係数はどうやって求めるのですか 下の問題も教えて 高校 教えて Goo




化学反応式の係数を決める 高校 化学 化学基礎 Youtube



化学変化 原子 分子 化学反応式のつくり方 中学生からの質問 理科 進研ゼミ中学講座 中ゼミ




โน ตของ 化学反応式 未定係数法についてのまとめ ช น Senior Clear




化学反応式の作り方を徹底解説 基礎から複雑な反応まで 高校生向け受験応援メディア 受験のミカタ



Http Heian Gacco Que Jp Hannnousiki Pdf




化学反応式 Chemical Equation Japaneseclass Jp




化学反応式 係数 作り方 書き方 計算問題の解き方など 化学のグルメ
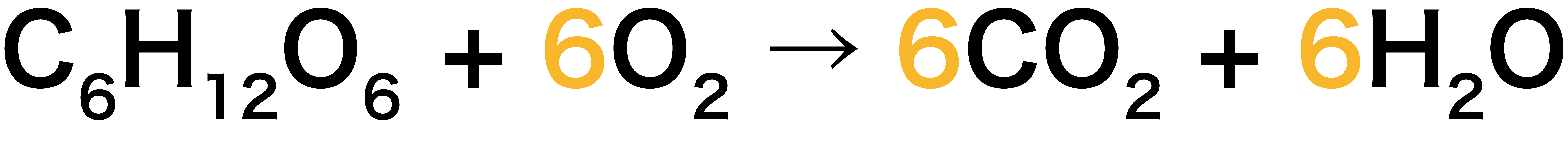



未定係数法 化学反応式の係数を決定する裏技のやり方を大公開 化学のグルメ




未定係数法を使い化学反応式の問題やその作り方のコツを身につけよう




化学反応式と物質量




化学変化と化学反応式の作り方 係数の決め方



化学基礎未定係数法の問題です 係数を補い 化学反応式を完成させよ Cu Yahoo 知恵袋




化学基礎の未定係数法なんですが 110の 2 を過程も含めて教えてくれ 化学 教えて Goo




高校化学基礎 係数と計算 映像授業のtry It トライイット



1




改訂化学基礎 改訂化学 ダイジェスト版




化学反応式の作り方 ボケのブログ




高校化学 1 7 の回答と 6 7 のイオン反応式の係数の合わせ方を教え 化学 教えて Goo




Ppt 化学反応式 Powerpoint Presentation Free Download Id



化学反応式の書き方



化学反応式



Q Tbn And9gcrgzuj00xua33t Bu1ddisikdg6uyi8gqtjeyj1jqa K78w1pnr Usqp Cau




次の化学反応式に係数をつけて反応式を完成させよ ってやつなんです その他 教育 科学 学問 教えて Goo



化学反応式




化学反応式と物質量




原子と分子 Ict教材eboard イーボード




過不足のある化学反応の問題を解くコツと必ず書くべき図 保存版




この問題が解けません 式に係数をつけて化学反応式を完成させます 誰 化学 教えて Goo




裏技 未定係数法で化学反応式をつくる方法 理解せずに作れる 化学受験テクニック塾



コメント
コメントを投稿